Koloid adalah suatu campuran zat heterogen antara dua zat atau lebih di mana partikel-partikel zat yang berukuran koloid tersebar merata dalam zat lain. Ukuran koloid berkisar antara 1-100 nm ( 10-7 – 10-5 cm ).
Contoh: Mayones dan cat, mayones adalah campuran homogen di air dan minyak dan cat adalah campuran homogen zat padat dan zat cair.
Sistem koloid adalah suatu bentuk campuran yang keadaannya terletak antara larutan dan suspensi (campuran kasar). Sistem koloid ini mempunyai sifat-sifat khas yang berbeda dari sifat larutan atau suspensi.
Keadaan koloid bukan ciri dari zat tertentu karena semua zat, baik padat, cair, maupun gas, dapat dibuat dalam keadaan koloid.
Sistem koloid sangat berkaitan erat dengan hidup dan kehidupan kita sehari-hari. Cairan tubuh, seperti darah adalah sistem koloid, bahan makanan seperti susu, keju, nasi, dan roti adalah sistem koloid. Cat, berbagai jenis obat, bahan kosmetik, tanah pertanian juga merupakan sistem koloid.
Karena sistem koloid sangat berpengaruh bagi kehidupan sehari-hari, kita harus mempelajarinya lebih mendalam agar kita dapat menggunakannya dengan benar dan dapat bermanfaat untuk diri kita.
Koloid adalah suatu sistem campuran “metastabil” (seolah-olah stabil, tapi akan memisah setelah waktu tertentu). Koloid berbeda dengan larutan; larutan bersifat stabil.
Di dalam larutan koloid secara umum, ada 2 zat sebagai berikut :
– Zat terdispersi, yakni zat yang terlarut di dalam larutan koloid
– Zat pendispersi, yakni zat pelarut di dalam larutan koloid
Berdasarkan fase terdispersi maupun fase pendispersi suatu koloid dibagi sebagai berikut :
| Fase Terdispersi |
Pendispersi |
Nama koloid |
Contoh |
| Gas |
Gas |
Bukan koloid, karena gas bercampur secara homogen |
| Gas |
Cair |
Busa |
Buih, sabun, ombak, krim kocok |
| Gas |
Padat |
Busa padat |
Batu apung, kasur busa |
| Cair |
Gas |
Aerosol cair |
Obat semprot, kabut, hair spray di udara |
| Cair |
Cair |
Emulsi |
Air santan, air susu, mayones |
| Cair |
Padat |
Gel |
Mentega, agar-agar |
| Padat |
Gas |
Aerosol padat |
Debu, gas knalpot, asap |
| Padat |
Cair |
Sol |
Cat, tinta |
| Padat |
Padat |
Sol Padat |
Tanah, kaca, lumpur |
Sifat Koloid
a. Efek Tyndall
Efek Tyndall adalah penghamburan cahaya oleh larutan koloid, peristiwa di mana jalannya sinar dalam koloid dapat terlihat karena partikel koloid dapat menghamburkan sinar ke segala jurusan.
Contoh: sinar matahari yang dihamburkan partikel koloid di angkasa, hingga langit berwarna biru pada siang hari dan jingga pada sore hari ; debu dalam ruangan akan terlihat jika ada sinar masuk melalui celah.
b. Gerak Brown
Gerak Brown adalah gerak partikel koloid dalam medium pendispersi secara terus menerus, karena adanya tumbukan antara partikel zat terdispersi dan zat pendispersi. Karena gerak aktif yang terus menerus ini, partikel koloid tidak memisah jika didiamkan.
c. Adsorbsi Koloid
Adsorbsi Koloid adalah penyerapan zat atau ion pada permukaan koloid. Sifat adsorbsi digunakan dalam proses:
1. Pemutihan gula tebu.
2. Norit.
3. Penjernihan air.
Contoh: koloid antara obat diare dan cairan dalam usus yang akan menyerap kuman penyebab diare.
Koloid Fe(OH)3 akan mengadsorbsi ion H+ sehingga menjadi bermuatan +. Adanya muatan senama maka koloid Fe(OH), akan tolak-menolak sesamanya sehingga partikel-partikel koloid tidak akan saling menggerombol.
Koloid As2S3 akan mengadsorbsi ion OH– dalam larutan sehingga akan bermuatan – dan tolak-menolak dengan sesamanya, maka koloid As2S3 tidak akan menggerombol.
d. Muatan Koloid dan Elektroforesis
Muatan Koloid ditentukan oleh muatan ion yang terserap permukaan koloid. Elektroforesis adalah gerakan partikel koloid karena pengaruh medan listrik.
Karena partikel koloid mempunyai muatan maka dapat bergerak dalam medan listrik. Jika ke dalam koloid dimasukkan arus searah melalui elektroda, maka koloid bermuatan positif akan bergerak menuju elektroda negatif dan sesampai di elektroda negatif akan terjadi penetralan muatan dan koloid akan menggumpal (koagulasi).
Contoh: cerobong pabrik yang dipasangi lempeng logam yang bermuatan listrik dengan tujuan untuk menggumpalkan debunya.
e. Koagulasi Koloid
Koagulasi koloid adalah penggumpalan koloid karena elektrolit yang muatannya berlawanan.
Contoh: kotoran pada air yang digumpalkan oleh tawas sehingga air menjadi jernih.
Faktor-faktor yang menyebabkan koagulasi:
- Perubahan suhu.
- Pengadukan.
- Penambahan ion dengan muatan besar (contoh: tawas).
- Pencampuran koloid positif dan koloid negatif.
Koloid akan mengalami koagulasi dengan cara:
1. Mekanik
Cara mekanik dilakukan dengan pemanasan, pendinginan atau pengadukan cepat.
2. Kimia
Dengan penambahan elektrolit (asam, basa, atau garam).
Contoh: susu + sirup masam —> menggumpal
Lumpur + tawas —> menggumpal
Dengan mencampurkan 2 macam koloid dengan muatan yang berlawanan.
Contoh: Fe(OH)3 yang bermuatan positif akan menggumpal jika dicampur As2S3 yang bermuatan negatif.
f. Koloid Liofil dan Koloid Liofob
– Koloid Liofil
Koloid Liofil adalah koloid yang mengadsorbsi cairan, sehingga terbentuk selubung di sekeliling koloid. Contoh: agar-agar.
– Koloid Liofob
Koloid Liofob adalah kolid yang tidak mengadsorbsi cairan. Agar muatan koloid stabil, cairan pendispersi harus bebas dari elektrolit dengan cara dialisis, yakni pemurnian medium pendispersi dari elektrolit.
g. Emulasi
Emulasi adalah kolid cairan dalam medium cair. Agar larutan kolid stabil, ke dalam koloid biasanya ditambahkan emulsifier, yaitu zat penyetabil agar koloid stabil.
Contoh: susu merupakan emulsi lemak di dalam air dengan kasein sebagai emulsifier.
h. Kestabilan Koloid
a. Banyak koloid yang harus dipertahankan dalam bentuk koloid untuk penggunaannya.
Contoh: es krim, tinta, cat.
Untuk itu digunakan koloid lain yang dapat membentuk lapisan di sekeliling koloid tersebut. Koloid lain ini disebut koloid pelindung.
Contoh: gelatin pada sol Fe(OH)3.
b. Untuk koloid yang berupa emulsi dapat digunakan emulgator yaitu zat yang dapat tertarik pada kedua cairan yang membentuk emulsi Contoh: sabun deterjen sebagai emulgator dari emulsi minyak dan air.
i. Pemurnian Koloid
Untuk memurnikan koloid yaitu menghilangkan ion-ion yang mengganggu kestabilan koloid, dapat dilakukan cara dialisis. Koloid yang akan dimurnikan dimasukkan ke kantong yang terbuat dari selaput semipermeabel yaitu selaput yang hanya dapat dilewati partikel ion saja dan tidak dapat dilewati molekul koloid.
Contoh: kertas perkamen, selopan atau kolodion.
Kantong koloid dimasukkan ke dalam bejana yang berisi air mengalir, maka ion-ion dalam koloid akan keluar dari kantong dan keluar dari bejana dan koloid tertinggal dalam kantong. Proses dialisis akan di percepat jika di dalam bejana diberikan arus listrik yang disebut elektro dialisis.
Proses pemisahan kotoran hasil metabolisme dari darah oleh ginjal termasuk proses dialisis. Maka apabila seseorang menderita gagal ginjal, orang tersebut harus menjalani “cuci darah” dengan mesin dialisator di rumah sakit. Koloid juga dapat dimurnikan dengan penyaring ultra.
Pembuatan Sistem Koloid
- Cara Kondensasi
Pembuatan sistem koloid dengan cara kondensasi dilakukan dengan cara penggumpalan partikel yang sangat kecil. Penggumpalan partikel ini dapat dilakukan dengan cara sebagai berikut:
1. Reaksi Pengendapan
Pembuatan sistem koloid dengan cara ini dilakukan dengan mencampurkan larutan elektrolit sehingga menghasilkan endapan. Contoh: AgNO3 + NaCl —> AgCl(s) + NaNO3
2. Reaksi Hidrolisis
Reaksi hidrolisis adalah reaksi suatu zat dengan air. Sistem koloid dapat dibuat dengan mereaksikan suatu zat dengan air. Contoh: AlCl3 +H2O —> Al(OH)3(s) + HCl
3. Reaksi Redoks
Pembuatan koloid dapat terbentuk dari hasil reaksi redoks.
Contoh: pada larutan emas
Reaksi: AuCl3 + HCOH —> Au + HCl + HCOOH
Emas formaldehid
4. Reaksi Pergeseran
Contoh: pembuatan sol As2S3 dengan cara mengalirkan gas H2S ke dalam laruatn H3AsO3 encer pada suhu tertentu.
Reaksi: 2 H3AsO3 + 3 H2S —> 6 H2O + As2S3
5. Reaksi Pergantian Pelarut
Contoh: pembuatan gel kalsium asetat dengan cara menambahkan alkohol 96% ke dalam larutan kalsium asetat jenuh.
2.Cara Dispersi
Pembuatan sistem koloid dengan cara dispersi dilakukan dengan memperkecil partikel suspensi yang terlalu besar menjadi partikel koloid, pemecahan partikel-partikel kasar menjadi koloid.
1. Cara Mekanik
Ukuran partikel suspensi diperkecil dengan cara penggilingan zat padat, dengan menghaluskan butiran besar kemudian diaduk dalam medium pendispersi.
Contoh: Gumpalan tawas digiling, dicampurkan ke dalam air akan membentuk koloid dengan kotoran air.
Membuat tinta dengan menghaluskan karbon pada penggiling koloid kemudian didispersikan dalam air.
Membuat sol belerang dengan menghaluskan belerang bersama gula (1:1) pada penggiling koloid, kemudian dilarutkan dalam air, gula akan larut dan belerang menjadi sol.
2. Cara Peptisasi
Pembuatan koloid dengan cara peptisasi adalah pembuatan koloid dengan menambahkan ion sejenis, sehingga partikel endapan akan dipecah. Contoh: sol Fe(OH)3 dengan menambahkan FeCl3.
sol NiS dengan menambahkan H2S.
karet dipeptisasi oleh bensin.
agar-agar dipeptisasi oleh air.
endapan Al(OH)3 dipeptisasi oleh AlCl3.
3. Cara Busur Bredia/Bredig
Pembuatan koloid dengan cara busur Bredia/Bredig dilakukan dengan mencelupkan 2 kawat logam (elektroda) yang dialiri listrik ke dalam air, sehingga kawat logam akan membentuk partikel koloid berupa debu di dalam air.
4. Cara Ultrasonik
yaitu penghancuran butiran besar dengan ultrasonik (frekuensi > 20.000 Hz)
Campuran heterogen.
Campuran homogen disebut larutan, contoh: larutan gula dalam air. Campuran heterogen dapat dibedakan menjadi 2 macam, yaitu: Sistem koloid termasuk dalam bentuk campuran. Campuran terbagi menjadi 2, yaitu:
1. Suspensi, contoh: pasir dalam air.
2. Koloid, contoh: susu dengan air.
Komponen Penyusun Koloid
1. Fase kontinyu : medium pendispersi jumlahnya lebih banyak.
2. Fase diskontinyu : medium terdispersi jumlahnya labih banyak.
Bentuk Partikel Koloid
1. Bulatan : misalnya virus, silika.
2. Batang : misalnya virus.
3. Piringan : misalnya globulin dalam darah.
4. Serat : misalnya selulosa.
Penggunaan Sistem Koloid
1. Obat-obatan : salep, krim, minyak ikan.
2. Makanan : es krim, jelly dan agar-agar.
3. Kosmetik : hair cream, skin spray, body lotion.
4. Industri : tinta, cat.
Beberapa Macam Koloid
1. Aerosol
adalah sistem koloid di mana partikel padat atau cair terdispersi dalam gas.
Contoh: aerosol padat: debu, asap.
aerosol cair: kabut, awan.
Bahan pendingin dan pendorong yang sering digunakan adalah Kloro Fluoro Karbon (CFC).
2. Emulsi
adalah sistem koloid di mana zat terdispersi dan pendispersi adalah zat cair yang tidak dapat bercampur. Misalnya: Emulsi minyak dalam air: santan, susu, lateks, minyak ikan. Emulsi air dalam minyak: mentega, minyak rambut, minyak bumi.
Untuk membentuk emulsi digunakan zat pengemulsi atau emulgator yaitu zat yang dapat tertarik oleh kedua zat cair tersebut.
Contoh: sabun untuk mengemulsikan minyak dan air.
kasein sebagai emulgator pada susu.
3. Sol adalah suatu sistem koloid di mana partikel padat terdispersi dalam zat cair.
|
No.
|
Hidrofob
|
Hidrofil
|
|
a.
|
Tidak menarik molekul air tetapi mengadsorbsi ion |
Menarik molekul air hingga menyelubungi partikel terdispersi |
|
b.
|
Tidak reversible, apabila mengalami koagulasi sukar menjadi sol lagi |
Reversibel, bila mengalami koagulasi akan dapat membentuk sol lagi jika ditambah lagi medium pendispersinya |
|
c.
|
Biasanya terdiri atas zat anorganik |
Biasanya terdiri atas zat organik |
|
d.
|
Kekentalannya rendah |
Kekentalannya tinggi |
|
e.
|
Gerak Brown terlihat jelas |
Gerak Brown tidak jelas |
|
f.
|
Mudah dikoagulasikan oleh elektrolit |
Sukar dikoagulasikan oleh elektrolit |
|
g.
|
Umumnya dibuat dengan cara kondensasi |
Umumnya dibuat dengan cara dispersi |
|
h.
|
Efek Tyndall jelas |
Efek Tyndall kurang jelas |
|
i.
|
Contoh: sol logam, sol belerang, sol Fe(OH)3, sol As2S3, sol sulfida |
Contoh: sol kanji, sol protein, sol sabun, sol gelatin |
4. Gel/Jel adalah koloid liofil setengah kaku.
Contoh: agar-agar, lem kanji, selai, jelly untuk menata rambut.
5. Buih adalah sistem koloid dari gas yang terdispersi dalam zat cair.
Contoh: sabun, detergen, protein.
Zat-zat yang dapat memecah/mencegah buih yaitu eter, isoamil alkohol.
SABUN/DETERGEN adalah zat yang molekulnya terdiri atas hidrofob dan sekaligus gugus hidrofil.
PENJERNIHAN AIR SUNGAI
1. Air sungai mengandung lumpur ditambah tawas –> air jernih.
2. Air jernih ditambah kaporit –> air jernih bebas kuman.
3. Air jernih bebas kuman disaring –> air bersih.
0.000000
0.000000
 Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.
Dikenal sebagai batu baterai. Terdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink. Elektrolit yang dipakai berupa pasta campuran MnO2, serbuk karbon dan NH4Cl.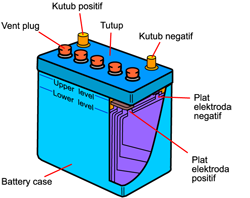 Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :
Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan . Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi PbO2.Reaksi penggunaan aki :

































 Jumlah penduduk dunia terus meningkat setiap tahunnya, sehingga peningkatan kebutuhan energi pun tak dapat dielakkan. Dewasa ini, hampir semua kebutuhan energi manusia diperoleh dari konversi sumber energi fosil, misalnya pembangkitan listrik dan alat transportasi yang menggunakan energi fosil sebagai sumber energinya. Secara langsung atau tidak langsung hal ini mengakibatkan dampak negatif terhadap lingkungan dan kesehatan makhluk hidup karena sisa pembakaran energi fosil ini menghasilkan zat-zat pencemar yang berbahaya.Pencemaran udara terutama di kota-kota besar telah menyebabkan turunnya kualitas udara sehingga mengganggu kenyamanan lingkungan bahkan telah menyebabkan terjadinya gangguan kesehatan. Menurunnya kualitas udara tersebut terutama disebabkan oleh penggunaan bahan bakar fosil yang tidak terkendali dan tidak efisien pada sarana transportasi dan industri yang umumnya terpusat di kota-kota besar, disamping kegiatan rumah tangga dan kebakaran hutan. Hasil penelitian dibeberapa kota besar (Jakarta, Bandung, Semarang dan Surabaya) menunjukan bahwa kendaraan bermotor merupakan sumber utama pencemaran udara. Hasil penelitian di Jakarta menunjukan bahwa kendaraan bermotor memberikan kontribusi pencemaran CO sebesar 98,80%, NOx sebesar 73,40% dan HC sebesar 88,90% (Bapedal, 1992).
Jumlah penduduk dunia terus meningkat setiap tahunnya, sehingga peningkatan kebutuhan energi pun tak dapat dielakkan. Dewasa ini, hampir semua kebutuhan energi manusia diperoleh dari konversi sumber energi fosil, misalnya pembangkitan listrik dan alat transportasi yang menggunakan energi fosil sebagai sumber energinya. Secara langsung atau tidak langsung hal ini mengakibatkan dampak negatif terhadap lingkungan dan kesehatan makhluk hidup karena sisa pembakaran energi fosil ini menghasilkan zat-zat pencemar yang berbahaya.Pencemaran udara terutama di kota-kota besar telah menyebabkan turunnya kualitas udara sehingga mengganggu kenyamanan lingkungan bahkan telah menyebabkan terjadinya gangguan kesehatan. Menurunnya kualitas udara tersebut terutama disebabkan oleh penggunaan bahan bakar fosil yang tidak terkendali dan tidak efisien pada sarana transportasi dan industri yang umumnya terpusat di kota-kota besar, disamping kegiatan rumah tangga dan kebakaran hutan. Hasil penelitian dibeberapa kota besar (Jakarta, Bandung, Semarang dan Surabaya) menunjukan bahwa kendaraan bermotor merupakan sumber utama pencemaran udara. Hasil penelitian di Jakarta menunjukan bahwa kendaraan bermotor memberikan kontribusi pencemaran CO sebesar 98,80%, NOx sebesar 73,40% dan HC sebesar 88,90% (Bapedal, 1992).

 Emisi CO2 adalah pemancaran atau pelepasan gas karbon dioksida (CO2) ke udara. Emisi CO2 tersebut menyebabkan kadar gas rumah kaca di atmosfer meningkat, sehingga terjadi peningkatan efek rumah kaca dan pemanasan global. CO2 tersebut menyerap sinar matahari (radiasi inframerah) yang dipantulkan oleh bumi sehingga suhu atmosfer menjadi naik. Hal tersebut dapat mengakibatkan perubahan iklim dan kenaikan permukaan air laut.
Emisi CO2 adalah pemancaran atau pelepasan gas karbon dioksida (CO2) ke udara. Emisi CO2 tersebut menyebabkan kadar gas rumah kaca di atmosfer meningkat, sehingga terjadi peningkatan efek rumah kaca dan pemanasan global. CO2 tersebut menyerap sinar matahari (radiasi inframerah) yang dipantulkan oleh bumi sehingga suhu atmosfer menjadi naik. Hal tersebut dapat mengakibatkan perubahan iklim dan kenaikan permukaan air laut.





























PENGOMENTAR TERAKHIR