Gas Mulia (Noble Gas)
Gas Mulia (Noble Gas) adalah bagian kecil dari atmosfer. Gas Mulia terletak pada Golongan VIIIA dalam sistem periodik. Gas mulia terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe), dan Radon (Rn). Keistimewaan unsur-unsur gas mulia adalah memiliki konfigurasi elektron yang sempurna (lengkap), dimana setiap kulit dan subkulit terisi penuh elektron. Dengan demikian, elektron valensi unsur gas mulia adalah delapan (kecuali unsur Helium dengan dua elektron valensi). Konfigurasi demikian menyebabkan gas mulia cenderung stabil dalam bentuk monoatomik dan sulit bereaksi dengan unsur lainnya.
Keberadaan unsur-unsur Gas Mulia pertama kali ditemukan oleh Sir William Ramsey. Beliau adalah ilmuwan pertama yang berhasil mengisolasi gas Neon, Argon, Kripton, dan Xenon dari atmosfer. Beliau juga menemukan suatu gas yang diisolasi dari peluruhan mineral Uranium, yang mempunyai spektrum sama seperti unsur di matahari, yang disebut Helium. Helium terdapat dalam mineral radioaktif dan tercatat sebagai salah satu gas alam di Amerika Serikat. Gas Helium diperoleh dari peluruhan isotop Uranium dan Thorium yang memancarkan partikel α. Gas Radon, yang semua isotopnya radioaktif dengan waktu paruh pendek, juga diperoleh dari rangkaian peluruhan Uranium dan Thorium.
Saat mempelajari reaksi kimia dengan menggunakan gas PtF6 yang sangat reaktif, N. Bartlett menemukan bahwa dengan oksigen, akan terbentuk suatu padatan kristal [O2]+[PtF6]–. Beliau mencatat bahwa entalpi pengionan Xenon sama dengan O2. Dengan demikian, suatu reaksi yang analog diharapkan dapat terjadi. Ternyata, hal tersebut benar. Pada tahun 1962, beliau melaporkan senyawa pertama yang berhasil disintesis menggunakan Gas Mulia, yaitu padatan kristal merah dengan formula kimia [Xe]+[PtF6]–. Selanjutnya, berbagai senyawa Gas Mulia juga berhasil disintesis, diantaranya XeF2, XeF4, XeF6, XeO4, dan XeOF4.
Seluruh unsur Gas Mulia merupakan gas monoatomik. Dalam satu golongan, dari He sampai Rn, jari-jari atom meningkat. Dengan demikian,ukuran atom Gas Mulia meningkat, menyebabkan gaya tarik-menarik antar atom (Gaya London) semakin besar. Hal ini mengakibatkan kenaikan titik didih unsur dalam satu golongan. Sementara energi ionisasi dalam satu golongan menurun dari He sampai Rn. Hal ini menyebabkan unsur He, Ne, dan Ar tidak dapat membentuk senyawa (energi ionisasinya sangat tinggi), sementara unsur Kr dan Xe dapat membentuk senyawa (energi ionisasinya relatif rendah dibandingkan Gas Mulia lainnya). Gas Argon merupakan Gas Mulia yang paling melimpah di atmosfer (sekitar 0,934% volume udara), sedangkan Gas Helium paling melimpah di jagat raya (terlibat dalam reaksi termonuklir pada permukaan matahari). (klik di sini untuk melihat sifat Gas Mulia dalam Tabel Periodik)
Gas Neon, Argon, Kripton, dan Xenon diperoleh dengan fraksionasi udara cair. Gas-gas tersebut pada dasarnya bersifat inert (stabil/lembam), sebab kereaktifan kimianya yang rendah, sebagai konsekuensi dari konfigurasi elektron yang lengkap. Kegunaan utama gas Helium adalah sebagai cairan dalam krioskopi. Gas Argon digunakan untuk menyediakan lingkungan yang inert dalam peralatan laboratorium, dalam pengelasan, dan dalam lampu listrik yang diisi gas. Sementara gas Neon digunakan untuk tabung sinar pemutusan muatan.
Halogen (Halogen)
Unsur Halogen (Golongan VIIA) adalah unsur-unsur nonlogam yang reaktif. Halogen terdiri dari unsur Fluor (F), Klor (Cl), Brom (Br), Iod (I), dan Astatin (At). Astatin adalah unsur radioaktif dengan waktu hidup (life time) yang sangat singkat dan mudah meluruh menjadi unsur lain. Dalam pembahasan ini, kita hanya akan membicarakan empat unsur pertama Halogen. Secara umum, unsur Halogen bersifat toksik dan sangat reaktif. Toksisitas dan reaktivitas Halogen menurun dari Fluor sampai Iod. (klik di sini untuk melihat sifat Halogen dalam Tabel Periodik)
Dalam satu golongan, dari Fluor sampai Iod, jari-jari atom meningkat. Akibatnya, interaksi antar atom semakin kuat, sehingga titik didih dan titik leleh pun meningkat. Dalam keadaan standar (tekanan 1 atm dan temperatur 25°C), Fluor adalah gas berwarna kekuningan, Klor adalah gas berwarna hijau pucat, Brom adalah cairan berwarna merah kecoklatan, dan Iod adalah padatan berwarna ungu-hitam. Energi ionisasi menurun dalam satu golongan , demikian halnya keelektronegatifan dan potensial standar reduksi (E°red). Ini berarti, Flour paling mudah tereduksi (oksidator kuat), sedangkan Iod paling sulit tereduksi (oksidator lemah).
Beberapa keistimewaan unsur Fluor yang tidak dimiliki unsur Halogen lainnya adalah sebagai berikut :
1. Fluor adalah unsur yang paling reaktif dalam Golongan Halogen. Hal ini terjadi akibat energi ikatan F-F yang relatif rendah (150,6 kJ/mol) dibandingkan energi ikatan Cl-Cl (242,7 kJ/mol) maupun Br-Br (192,5 kJ/mol). Sebagai tambahan, ukuran atom F yang kecil menyebabkan munculnya tolakan yang cukup kuat antar lone pair F-F, sehingga ikatan F-F tidak stabil dan mudah putus. Hal ini tidak terjadi pada ikatan Cl-Cl maupun Br-Br sehingga keduanya relatif stabil dibandingkan ikatan F-F.
2. Senyawa Hidrogen Fluorida (HF) memiliki titik didih tertinggi akibat adanya ikatan Hidrogen. Sementara senyawa halida lainnya (HCl, HBr, dan HI) memiliki titik didih yang relatif rendah.
3. Hidrogen Fluorida (HF) adalah asam lemah, sedangkan asam halida lainnya (HCl, HBr, dan HI) adalah asam kuat.
4. Gas Fluor dapat bereaksi dengan larutan natrium hidroksida (NaOH) membentuk oksigen difluorida yang dapat dinyatakan dalam persamaan reaksi berikut :
2 F2(g) + 2 NaOH(aq) ——> 2 NaF(aq) + H2O(l) + OF2(g)
Sementara itu, reaksi yang analog juga terjadi pada Klor dan Brom, dengan produk yang berbeda. Reaksi yang terjadi adalah sebagai berikut :
Cl2(g) + 2 NaOH(aq) ——> NaCl(aq) + NaOCl(aq) + H2O(l)
Br2(l) + 2 NaOH(aq) ——> NaBr(aq) + NaOBr(aq) + H2O(l)
Kedua reaksi di atas dikenal dengan istilah Reaksi Disproporsionasi (Autoredoks). Iod tidak dapat bereaksi dalam kondisi ini
5. Senyawa Perak Fluorida (AgF) mudah larut dalam air, sedangkan perak halida lainnya (AgCl, AgBr, dan AgI) sukar larut dalam air.
Unsur Halogen membentuk berbagai variasi senyawa. Dalam keadaan standar, unsur bebas Halogen membentuk molekul diatomik (F2, Cl2, Br2, I2). Oleh karena kereaktifannya yang besar, Halogen jarang ditemukan dalam keadaan bebas. Halogen umumnya ditemukan dalam bentuk senyawa. Halogen yang ditemukan dalam air laut berbentuk halida (Cl–, Br–, dan I–). Sementara di kerak bumi, halogen berikatan dalam mineral, seperti Fluorite (CaF2) dan kriolit (Na3AlF6).
Antar Halogen dapat mengalami reaksi kimia. Oleh karena kekuatan oksidator menurun dari Fluor sampai Iod, Halogen dapat mengoksidasi Ion Halida yang terletak di bawahnya (displacement reaction). Dengan demikian, reaksi yang terjadi antar Halogen dapat disimpulkan dalam beberapa pernyataan di bawah ini :
1. F2 dapat mengoksidasi Cl– menjadi Cl2, Br– menjadi Br2, serta I– menjadi I2.
2. Cl2 dapat mengoksidasi Br– menjadi Br2, serta I– menjadi I2. Cl2 tidak dapat mengoksidasi F– menjadi F2.
3. Br2 dapat mengoksidasi I– menjadi I2. Br2 tidak dapat mengoksidasi F– menjadi F2 maupun Cl– menjadi Cl2.
4. I2 tidak dapat mengokisdasi F– menjadi F2, Cl– menjadi Cl2, serta Br– menjadi Br2.
Gas F2 dapat diperoleh dari elektrolisis cairan (bukan larutan) Hidrogen Fluorida yang diberi sejumlah padatan Kalium Fluorida untuk meningkatkan konduktivitas pada temperatur di atas 70°C. Di katoda, ion H+ akan tereduksi menjadi gas H2, sedangkan di anoda, ion F‑ akan teroksidasi menjadi gas F2.
Gas Cl2 dapat di peroleh melalui elektrolisis lelehan NaCl maupun elektrolisis larutan NaCl. Melalui kedua elektrolisis tersebut, ion Cl– akan teroksidasi membentuk gas Cl2 di anoda. Gas Cl2 juga dapat diperoleh melalui proses klor-alkali, yaitu elektrolisis larutan NaCl pekat (brine). Reaksi yang terjadi pada elektrolisis brine adalah sebagai berikut :
2 NaCl(aq) + 2 H2O(l) ——> 2 NaOH(aq) + H2(g) + Cl2(g)
Di laboratorium, unsur Klor, Brom, dan Iod dapat diperoleh melalui reaksi alkali halida (NaCl, NaBr, NaI) dengan asam sulfat pekat yang dipercepat dengan penambahan MnO2 sebagai katalis. Reaksi yang terjadi adalah sebagai berikut :
MnO2(s) + 2 H2SO4(aq) + 2 NaCl(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + Cl2(g)
MnO2(s) + 2 H2SO4(aq) + 2 NaBr(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + Br2(l)
MnO2(s) + 2 H2SO4(aq) + 2 NaI(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + I2(s)
Halida dibedakan menjadi dua kategori, yaitu halida ionik dan halida kovalen. Fluorida dan klorida dari unsur logam, terutama unsur Alkali dan Alkali Tanah (kecuali Berilium) merupakan halida ionik. Sementara, flurida dan klorida dari unsur nonlogam, seperti Belerang dan Fosfat merupakan halida kovalen. Bilangan oksidasi Halogen bervariasi dari -1 hingga +7 (kecuali Fluor). Unsur Fluor yang merupakan unsur dengan keelektronegatifan terbesar di alam, hanya memiliki bilangan oksidasi 0 (F2) dan -1 (fluorida).
Halogen dapat bereaksi dengan Hidrogen menghasilkan Hidrogen Halida. Reaksi yang terjadi adalah sebagai berikut :
X2(g) + H2(g) ——> 2 HX(g)
X = F, Cl, Br, atau I
Reaksi ini (khususnya pada F2 dan Cl2)menimbulkan ledakan hebat (sangat eksotermis). Oleh karena itu, reaksi tersebut jarang digunakan di industri. Sebagai pengganti, hidrogen halida dapat dihasilkan melalui reaksi klorinasi hidrokarbon. Sebagai contoh :
C2H6(g) + Cl2(g) ——> C2H5Cl(g) + HCl(g)
Di laboratorium, hidrogen halida dapat diperoleh melalui reaksi antara logam halida dengan asam sulfat pekat. Reaksi yang terjadi adalah sebagai berikut :
CaF2(s) + H2SO4{aq) ——> 2 HF(g) + CaSO4(s)
2 NaCl(s) + H2SO4(aq) ——-> 2 HCl(g) + Na2SO4(aq)
Hidrogen Bromida dan Hidrogen Iodida tidak dapat dihasilkan melalui cara ini, sebab akan terjadi reaksi oksidasi (H2SO4 adalah oksidator kuat) yang menghasilkan Brom dan Iod. Reaksi yang terjadi adalah sebagai berikut :
2 NaBr(s) + 2 H2SO4(aq) ——> Br2(l) + SO2(g) + Na2SO4(aq) + 2 H2O(l)
Hidrogen Bromida dapat dibuat melalui beberapa reaksi berikut :
P4(s) + 6 Br2(l) ——> 4 PBr3(l)
PBr3(l) + 3 H2O(l) ——> 3 HBr(g) + H3PO3(aq)
Hidrogen Iodida dapat diperoleh dengan cara serupa.
Hidrogen Fluorida memiliki kereaktifan yang tinggi. Senyawa ini dapat bereaksi dengan silika melalui persamaan reaksi berikut :
6 HF(aq) + SiO2(s) ——> H2SiF6(aq) + 2 H2O(l)
Hidrogen Fluorida juga digunakan dalam proses pembuatan gas Freon. Reaksi yang terjadi adalah sebagai berikut :
CCl4(l) + HF(g) ——> CCl3F(g) + HCl(g)
CCl3F(g) + HF(g) ——> CCl2F2(g) + HCl(g)
Larutan Hidrogen Halida bersifat asam. Urutan kekuatan asam halida adalah HF << HCl < HBr < HI. Sedangkan urutan kekuatan asam oksi adalah HXO < HXO2 < HXO3 < HXO4 (X = Cl, Br, atau I).
Fluor (khususnya NaF) ditambahkan ke dalam air minum untuk mencegah terbentuknya karies (kerak atau plak) gigi. Senyawa lain, Uranium Fluorida, UF6, digunakan untuk memisahkan isotop radioaktif Uranium (U-235 dan U-238). Di bidang industri, Fluor digunakan untuk menghasilkan poli tetra fluoro etilena (Teflon).
Klor (khusunya Klorida, Cl–) memegang peranan penting dalam sistem kesetimbangan cairan interseluler dan ekstraseluler dalam organisme. Di bidang industri, Klor digunakan sebagai bahan pemutih (bleaching agent) pada industri kertas dan tekstil. Bahan pembersih rumah tangga umumnya mengandung sejumlah Klor (khususnya NaClO) yang berperan sebagai bahan aktif pengangkat kotoran. Sementara, senyawa klor lainnya, HClO, berfungsi sebagai agen desinfektan pada proses pemurnian air. Reaksi yang terjadi saat gas Klor dilarutkan dalam air adalah sebagai berikut :
Cl2(g) + H2O(l) ——> HCl(aq) + HClO(aq)
Ion OCl– yang dihasilkan dari reaksi tersebut berperan sebagai agen desinfektan yang membunuh kuman dalam air.
Metana yang terklorinasi, seperti Karbon Tetraklorida (CCl4) dan Kloroform (CHCl3) digunakan sebagai pelarut senyawa organik. Klor juga digunakan dalam pembuatan insektisida, seperti DDT. Akan tetapi, penggunaan DDT dapat mencemari lingkungan, sehingga kini penggunaannya dilarang atau dibatasi sesuai dengan Undang-Undang Lingkungan. Klor juga digunakan sebagai bahan baku pembuatan poli vinil klorida (PVC).
Senyawa Bromida ditemukan di air laut (ion Br–). Brom digunakan sebagai bahan dasar pembuatan senyawa Etilena Dibromida (BrCH2CH2Br), suatu insektisida. Senyawa ini sangat karsinogenik. Di samping itu, Brom juga dapat bereaksi dengan Perak menghasilkan senyawa Perak Bromide (AgBr) yang digunakan dalam lembaran film fotografi.
Iod jarang digunakan dalam kehidupan sehari-hari. Larutan Iod dalam alkohol (50% massa) sering digunakan di dunia medis sebagai zat antiseptik. Iod juga merupakan salah satu komponen dari hormon tiroid. Defisiensi Iod dapat mengakibatkan pembengkakan kelenjar gondok.
Alkali (Alkali)
Logam Alkali (Golongan IA) adalah unsur yang sangat elektropositif (kurang elektronegatif). Umumnya, logam Alkali berupa padatan dalam suhu ruang. Unsur Alkali terdiri dari Litium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Fransium jarang dipelajari sebagai salah satu anggota unsur Golongan IA, sebab Fransium adalah unsur radioaktif yang tidak stabil dan cenderung meluruh membentuk unsur baru lainnya. Dari konfigurasi elektron unsur, masing-masing memiliki satu elektron valensi . Dengan demikian, unsur Alkali cenderung membentuk ion positif bermuatan satu (M+). (klik di sini untuk melihat sifat Alkali dalam Tabel Periodik)
Dalam satu golongan, dari Litium sampai Sesium, jari-jari unsur akan meningkat. Letak elektron valensi terhadap inti atom semakin jauh. Oleh sebab itu, kekuatan tarik-menarik antara inti atom dengan elektron valensi semakin lemah. Dengan demikian, energi ionisasi akan menurun dari Litium sampai Sesium. Hal yang serupa juga ditemukan pada sifat keelektronegatifan unsur .
Secara umum, unsur Alkali memiliki titik leleh yang cukup rendah dan lunak, sehingga logam Alkali dapat diiris dengan pisau. Unsur Alkali sangat reaktif, sebab mudah melepaskan elektron (teroksidasi) agar mencapai kestabilan (konfigurasi elektron ion Alkali menyerupai konfigurasi elektron Gas Mulia). Dengan demikian, unsur Alkali jarang ditemukan bebas di alam. Unsur Alkali sering dijumpai dalam bentuk senyawanya. Unsur Alkali umumnya bereaksi dengan unsur lain membentuk senyawa halida, sulfat, karbonat, dan silikat.
Natrium dan Kalium terdapat dalam jumlah yang melimpah di alam. Keduanya terdapat dalam mineral seperti albite (NaAlSi3O8) dan ortoklas (KAlSi3O8). Selain itu, mineral lain yang mengandung Natrium dan Kalium adalah halite (NaCl), Chile saltpeter (NaNO3), dan silvit (KCl).
Logam Natrium dapat diperoleh dari elektrolisis lelehan NaCl (proses Down). Titik leleh senyawa NaCl cukup tinggi (801°C), sehingga diperlukan jumlah energi yang besar untuk melelehkan padatan NaCl. Dengan menambahkan zat aditif CaCl2, titik leleh dapat diturunkan menjadi sekitar 600°C, sehingga proses elektrolisis dapat berlangsung lebih efektif tanpa pemborosan energi.
Sebaliknya, logam Kalium tidak dapat diperoleh melalui metode elektrolisis lelehan KCl. Logam Kalium hanya dapat diperoleh melalui reaksi antara lelehan KCl dengan uap logan Natrium pada suhu 892°C. Reaksi yang terjadi adalah sebagai berikut :
Na(g) + KCl(l) <——> NaCl(l) + K(g)
Natrium dan Kalium adalah unsur logam yang sangat reaktif. Logam Kalium lebih reaktif dibandingkan logam Natrium. Kedua logam tersebut dapat berekasi dengan air membentuk hidroksida. Saat direaksikan dengan oksigen dalam jumlah terbatas, Natrium dapat membentuk oksidanya (Na2O). Namun, dalam jumlah oksigen berlebih, Natrium dapat membentuk senyawa peroksida (Na2O2).
2 Na(s) + O2(g) ——> Na2O2(s)
Natrium peroksida bereaksi dengan air menghasilkan larutan hidroksida dan hidrogen peroksida. Reaksi yang terjadi adalah sebagai berikut :
Na2O2(s) + 2 H2O(l) ——> 2 NaOH(aq) + H2O2(aq)
Sama seperti Natrium, logam Kalium dapat membentuk peroksida saat bereaksi dengan oksigen berlebih. Selain itu, logam Kalium juga membentuk superoksida saat dibakar di udara. Reaksi yang terjadi adalah sebagai berikut :
K(s) + O2(g) ——> KO2(s)
Saat Kalium Superoksida dilarutkan dalam air, akan dibentuk gas oksigen. Reaksi yang terjadi adalah sebagai berikut :
2 KO2(s) + 2 H2O(l) ——> 2 KOH(aq) + O2(g) + H2O2(aq)
Unsur Natrium dan Kalium berperan penting dalam mengatur keseimbangan cairan dalam tubuh. Ion Natrium dan ion Kalium terdapat dalam cairan intraseluler dan ekstraseluler. Keduanya berperan penting dalam menjaga tekanan osmosis cairan tubuh serta mempertahankan fungsi enzim dalam mengkatalisis reaksi biokimia dalam tubuh.
Natrium Karbonat (soda abu) digunakan dalam industri pengolahan air dan industri pembuatan sabun, detergen, obat-obatan, dan zat aditif makanan. Selain itu, Natrium Karbonat digunakan juga pada industri gelas. Senyawa ini dibentuk melalui proses Solvay. Reaksi yang terjadi pada proses Solvay adalah sebagai berikut :
NH3(aq) + NaCl(aq) + H2CO3(aq) ——> NaHCO3(s) + NH4Cl(aq)
2 NaHCO3(s) ——> Na2CO3(s) + CO2(g) + H2O(g)
Sumber mineral lain yang mengandung senyawa Natrium Karbonat adalah trona, dengan formula kimia [Na5(CO3)2(HCO3).2H2O]. Mineral ini ditemukan dalam jumlah besar di Wyoming, Amerika Serikat. Ketika mineral trona dipanaskan, akan terjadi reaksi penguraian sebagai berikut :
2 Na5(CO3)2(HCO3).2H2O(s) ——> 5 Na2CO3(s) + CO2(g) + 3 H2O(g)
Natrium Hidroksida dan Kalium Hidroksida masing-masing diperoleh melalui elektrolisis larutan NaCl dan KCl. Kedua hidroksida ini merupakan basa kuat dan mudah larut dalam air. Larutan NaOH digunakan dalam pembuatan sabun . Sementara itu, larutan KOH digunakan sebagai larutan elektrolit pada beberapa baterai (terutama baterai merkuri).
Chile saltpeter (Natrium Nitrat) terurai membentuk gas oksigen pada suhu 500°C. Reaksi penguraian yang terjadi adalah sebagai berikut :
2 NaNO3(s) ——> 2 NaNO2(s) + O2(g)
Kalium Nitrat (saltpeter) dapat dibuat melalui reaksi berikut :
KCl(aq) + NaNO3(aq) ——> KNO3(aq) + NaCl(aq)
Alkali Tanah (Alkaline Earth)
Unsur Alkali Tanah mempunyai sifat yang menyerupai unsur Alkali. Unsur Alkali Tanah umumnya merupakan logam, cenderung membentuk ion positif, dan bersifat konduktif, baik termal maupun elektrik. Unsur Alkali Tanah kurang elektropositif (lebih elektronegatif) dan kurang reaktif bila dibandingkan unsur Alkali. Semua unsur Golongan IIA ini memiliki sifat kimia yang serupa, kecuali Berilium (Be). Yang termasuk unsur Golongan IIA adalah Berilium (Be), Magnesium (Mg), Kalsium (Ca), Stronsium (Sr), Barium (Ba), dan Radium (Ra). Radium jarang dipelajari sebagai salah satu anggota unsur Golongan IIA, sebab Radium adalah unsur radioaktif yang tidak stabil dan cenderung meluruh membentuk unsur baru lainnya. Konfigurasi elektron menunjukkan unsur-unsur Golongan IIA memiliki dua elektron valensi. Dengan demikian, untuk mencapai kestabilan, unsur Golongan IIA melepaskan dua elektron membentuk ion bermuatan positif dua (M2+). (klik di sini untuk melihat sifat Alkali Tanah dalam Tabel Periodik)
Dalam satu golongan, dari Berilium sampai Barium, jari-jari unsur meningkat. Peningkatan ukuran atom diikuti dengan peningkatan densitas unsur. Sebaliknya, energi ionisasi dan keelektronegatifan berkurang dari Berilium sampai Radium. Semakin besar jari-jari unsur, semakin mudah unsur melepaskan elektron valensinya. Potensial standar reduksi (E°red) menurun dalam satu golongan. Hal ini menunjukkan bahwa kekuatan reduktor meningkat dalam satu golongan dari Berilium sampai Barium.
Magnesium adalah unsur yang cukup melimpah di kerak bumi (urutan keenam, sekitar 2,5% massa kerak bumi). Beberapa bijih mineral yang mengandung logam Magnesium, antara lain brucite, Mg(OH)2, dolomite (CaCO3.MgCO3), dan epsomite (MgSO4.7H2O). Air laut merupakan sumber Magnesium yang melimpah (1,3 gram Magnesium per kilogram air laut). Magnesium diperoleh melalui elektrolisis lelehan MgCl2.
Magnesium tidak bereaksi dengan air dingin. Magnesium hanya bereaksi dengan air panas (uap air). Reaksi yang terjadi adalah sebagai berikut :
Mg(s) + H2O(g) ——> MgO(s) + H2(g)
Magnesium juga bereaksi dengan udara membentuk Magnesium Oksida dan Magnesium Nitrida. Reaksi yang terjadi adalah sebagai berikut :
2 Mg(s) + O2(g) ——> 2 MgO(s)
3 Mg(s) + N2(g) ——> Mg3N2(s)
Magnesium Oksida bereaksi lambat dengan air menghasilkan Magnesium Hidroksida (milk of magnesia), yang digunakan sebagai zat aktif untuk menetralkan asam lambung berlebih. Reaksi pembentukan milk of magnesia adalah sebagai berikut :
MgO(s) + H2O(l) ——> Mg(OH)2(s)
Hidroksida dari Magnesium merupakan basa kuat. Semua unsur Golongan IIA membentuk basa kuat, kecuali Be(OH)2 yang bersifat amfoter. Senyawa bikarbonat, MgHCO3 (maupun CaHCO3), menyebabkan kesadahan air sementara (dapat dihilangkan dengan cara pemanasan).
Logam Magnesium terutama digunakan dalam bidang konstruksi. Sifatnya yang ringan menjadikannya sebagai pilihan utama dalam pembentukan alloy (paduan logam). Logam Magnesium juga digunakan dalam proteksi katodik untuk mencegah logam besi dari korosi (perkaratan), reaksi kimia organik (reaksi Grignard), dan sebagai elektroda baterai . Sementara itu, dalam sistem kehidupan, ion Mg2+ ditemukan dalam klorofil (zat hijau daun) tumbuhan dan berbagai enzim pada organisme yang mengkatalisis reaksi biokimia penunjang kehidupan.
Kerak bumi mengandung 3,4 persen massa unsur Kalsium. Kalsium dapat ditemukan dalam berbagai senyawa di alam, seperti limestone, kalsit, dan batu gamping (CaCO3); dolomite (CaCO3.MgCO3); gypsum (CaSO4.2H2O); dan fluorite (CaF2). Logam Kalsium dapat diperoleh melalui elektrolisis lelehan CaCl2.
Kalsium (sama seperti Stronsium dan Barium) dapat bereaksi dengan air dingin membentuk hidroksida, Ca(OH)2. Senyawa Ca(OH)2 ini dikenal dengan istilah slaked lime atau hydrate lime. Reaksi tersebut jauh lebih lambat bila dibandingkan reaksi logam Alkali dengan air.
Ca(s) + 2 H2O(l) ——> Ca(OH)2(aq) + H2(g)
Kapur (lime), CaO, atau sering disebut dengan istilah quicklime, adalah salah satu material tertua yang dikenal manusia sejak zaman purba. Quicklime dapat diperoleh melalui penguraian termal senyawa Kalsium Karbonat. Reaksi yang terjadi adalah sebagai berikut :
CaCO3(s) ——> CaO(s) + CO2(g)
Slaked lime juga dapat dihasilkan melalui reaksi antara quicklime dengan air. Reaksi yang terjadi adalah sebagai berikut :
CaO(s) + H2O(l) ——> Ca(OH)2(aq)
Quicklime digunakan pada industri metalurgi sebagai zat aktif untuk menghilangkan SO2 pada bijih mineral. Sementara slaked lime digunakan dalam pengolahan air bersih. Logam Kalsium digunakan sebagai agen penarik air (dehydrating agent) pada pelarut organik. Unsur Kalsium merupakan komponen utama penyusun tulang dan gigi. Ion kalsium dalam tulang dan gigi terdapat dalam senyawa kompleks garam fosfat, yaitu hidroksiapatit (Ca5(PO4)3OH). Ion Kalsium juga berfungsi sebagai kofaktor berbagai enzim, faktor penting dalam proses pembekuan darah, kontraksi otot, dan transmisi sinyal sistem saraf pusat.
Untuk membedakan unsur-unsur Golongan IIA, dapat dilakukan pengujian kualitatif melalui tes nyala. Saat masing-masing unsur dibakar dengan pembakar Bunsen, akan dihasilkan warna nyala yang bervariasi. Magnesium menghasilkan nyala berwarna putih terang, Kalsium menghasilkan nyala berwarna merah bata, Stronsium menghasilkan nyala berwarna merah terang, sedangkan Barium menghasilkan nyala berwarna hijau.
Garam yang terbentuk dari unsur Golongan IIA merupakan senyawa kristalin ionik tidak berwarna. Garam tersebut dapat dibentuk melalui reaksi logam, oksida logam, atau senyawa karbonat dengan asam. Berikut ini adalah contoh beberapa reaksi pembentukan garam :
1. Mg(s) + 2 HCl(aq) ——> MgCl2(aq) + H2(g)
2. MgO(s) + 2 HCl(aq) ——> MgCl2(aq) + H2O(l)
3. MgCO3(s) + 2 HCl(aq) ——> MgCl2(aq) + H2O(l) + CO2(g)
Senyawa nitrat mengalami penguraian termal membentuk oksida logam, nitrogen dioksida, dan gas oksigen. Sebagai contoh :
2 Mg(NO3)2(s) ——> 2 MgO(s) + 4 NO2(g) + O2(g)
Senyawa karbonat mengalami penguraian termal membentuk oksida logam dan gas karbon dioksida. Sebagai contoh :
BaCO3(s) ——> BaO(s) + CO2(g)
Unsur-Unsur Periode Ketiga (Periode 3 Elements)
Unsur-unsur periode ketiga memiliki sifat kimia dan sifat fisika yang bervariasi. Unsur-unsur yang terdapat pada periode ketiga adalah Natrium (Na), Magnesium (Mg), Aluminium (Al), Silikon (Si), Fosfor (P), Belerang (S), Klor (Cl), dan Argon (Ar). Dari kiri (Natrium) sampai kanan (Argon), jari-jari unsur menyusut, sedangkan energi ionisasi, afinitas elektron, dan keelektronegatifan meningkat. Selain itu, terjadi perubahan sifat unsur dari logam (Na, Mg, Al) menjadi semilogam/metaloid (Si), nonlogam (P, S, Cl), dan gas mulia (Ar). Unsur logam umumnya membentuk struktur kristalin, sedangkan unsur semilogam/metaloid membentuk struktur molekul raksasa (makromolekul). Sementara, unsur nonlogam cenderung membentuk struktur molekul sederhana. Sebaliknya, unsur gas mulia cenderung dalam keadaan gas monoatomik. Variasi inilah yang menyebabkan unsur periode ketiga dapat membentuk berbagai senyawa dengan sifat yang berbeda. (klik di sini untuk melihat sifat Unsur Periode Ketiga dalam Tabel Periodik)
Unsur-unsur periode ketiga dapat membentuk oksida melalui reaksi pembakaran dengan gas oksigen. Reaksi yang terjadi pada masing-masing unsur adalah sebagai berikut :
1. Natrium Oksida
Natrium mengalami reaksi hebat dengan oksigen. Logam Natrium yang terpapar di udara dapat bereaksi spontan dengan gas oksigen membentuk oksida berwarna putih yang disertai nyala berwarna kuning.
4 Na(s) + O2(g) ——> 2 Na2O(s)
2. Magnesium Oksida
Magnesium juga bereaksi hebat dengan udara (terutama gas oksigen) menghasilkan nyala berwarna putih terang yang disertai dengan pembentukan oksida berwarna putih.
2 Mg(s) + O2(g) ——> 2 MgO(s)
3. Aluminium Oksida
Oksida ini berfungsi mencegah (melindungi) logam dari korosi. Oksida ini berwarna putih.
4 Al(s) + 3 O2(g) ——> 2 Al2O3(s)
4. Silikon Oksida (Silika)
Si(s) + O2(g) ——> SiO2(s)
5. Fosfor (V) Oksida
Fosfor mudah terbakar di udara. Ketika terdapat gas oksigen dalam jumlah berlebih, oksida P4O10 yang berwarna putih akan dihasilkan.
P4(s) + 5 O2(g) ——> P4O10(s)
6. Belerang Dioksida dan Belerang Trioksida
Padatan Belerang mudah terbakar di udara saat dipanaskan dan akan menghasilkan gas Belerang Dioksida (SO2). Oksida ini dapat direaksikan lebih lanjut dengan gas oksigen berlebih yang dikatalisis oleh Vanadium Pentaoksida (V2O5) untuk menghasilkan gas Belerang Trioksida (SO3).
S(s) + O2(g) ——>SO2(g)
2 SO2(g) + O2(g) ——> 2SO3(g)
7. Klor (VII) Oksida
2 Cl2(g) + 7 O2(g) ——> 2 Cl2O7(g)
Selain dapat membentuk oksida, unsur-unsur periode ketiga juga dapat membentuk senyawa halida. Senyawa tersebut terbentuk saat unsur direaksikan dengan gas klor. Reaksi yang terjadi pada masing-masing unsur adalah sebagai berikut :
1. Natrium Klorida
Natrium direaksikan dengan gas klor akan menghasilkan endapan putih NaCl.
2 Na(s) + Cl2(g) ——> 2 NaCl(s)
2. Magnesium Klorida
Sama seperti Natrium, logam Magnesium pun dapat bereaksi dengan gas klor membentuk endapan putih Magnesium Klorida.
Mg(s) + Cl2(g) ——> MgCl2(s)
3. Aluminium Klorida
Ketika logam Aluminium direaksikan dengan gas klor, akan terbentuk endapan putih AlCl3.
2 Al(s) + 3 Cl2(g) ——> 2 AlCl3(s)
Dalam bentuk uap, senyawa ini akan membentuk dimer Al2Cl6.
4. Silikon (IV) Klorida
Senyawa ini merupakan cairan yang mudah menguap. Senyawa ini dihasilkan dari reaksi padatan Silikon dengan gas klor.
Si(s) + 2 Cl2(g) ——> SiCl4(l)
5. Fosfor (III) Klorida dan Fosfor (V) Klorida
Fosfor (III) Klorida merupakan cairan mudah menguap tidak berwarna yang dihasilkan saat Fosfor bereaksi dengan gas klor tanpa pemanasan. Saat jumlah gas klor yang digunakan berlebih, senyawa ini dapat bereaksi kembali dengan gas klor berlebih membentuk senyawa Fosfor (V) Klorida, suatu padatan berwarna kuning.
P4(s) + 6 Cl2(g) ——> 4 PCl3(l)
Saat jumlah gas klor yang digunakan berlebih, akan terjadi reaksi berikut :
PCl3(l) + Cl2(g) ——> PCl5(s)
6. Belerang (II) Oksida
S(s) + Cl2(g) ——> SCl2(s)
Reaksi antara logam Natrium dan Magnesium dengan air adalah reaksi redoks. Dalam reaksi ini, unsur logam mengalami oksidasi dan dihasilkan gas hidrogen. Larutan yang dihasilkan bersifat alkali (basa). Logam Natrium lebih reaktif dibandingkan logam Magnesium, sehingga larutan NaOH bersifat lebih basa dibandingkan larutan Mg(OH)2.Padatan NaOH lebih mudah larut dalam air dibandingkan padatan Mg(OH)2.
Oksida dari logam Natrium dan Magnesium merupakan senyawa ionik dengan struktur kristalin. Saat dilarutkan dalam air, masing-masing oksida akan menghasilkan larutan basa. Oleh karena itu, dapat disimpulkan bahwa oksida logam dalam air menghasilkan larutan basa.
Na2O(s) + H2O(l) ——> 2 NaOH(aq)
MgO(s) + H2O(l) ——> Mg(OH)2(aq)
Aluminium Oksida memiliki struktur kristalin dan memiliki sifat kovalen yang cukup signifikan. Dengan demikian, senyawa ini dapat membentuk ikatan antarmolekul (intermediate bonding). Senyawa ini sukar larut dalam air.
Fosfor (V) Oksida merupakan senyawa kovalen. Senyawa ini dapat bereaksi dengan air membentuk asam fosfat. Asam fosfat merupakan salah satu contoh larutan asam lemah dengan pH berkisar antara 2 hingga 4. Reaksi yang terjadi adalah sebagai berikut :
P4O10(s) + 6 H2O(l) ——> 4 H3PO4(aq)
Belerang Dioksida dan Belerang Trioksida mempunyai struktur molekul kovalen sederhana. Masing-masing dapat bereaksi dengan air membentuk larutan asam.
SO2(g) + H2O(l) ——> H2SO3(aq)
SO3(g) + H2O(l) ——> H2SO4(aq)
Dengan demikian, senyawa oksida yang dihasilkan dari unsur periode ketiga dapat dikelompokkan menjadi tiga kategori, yaitu :
1. Oksida Logam (di sebelah kiri Tabel Periodik) memiliki struktur ionik kristalin dan bereaksi dengan air menghasilkan larutan basa. Oksida Logam merupakan oksida basa, yang dapat bereaksi dengan asam membentuk garam.
MgO(s) + H2SO4(aq) ——> MgSO4(aq) + H2O(l)
2. Oksida Nonlogam (di sebelah kanan Tabel Periodik) memiliki struktur molekul kovelen sederhana dan bereaksi dengan air menghasilkan larutan asam. Oksida nonlogam merupakan oksida asam, yang dapat bereaksi dengan basa membentuk garam.
SO3(g) + MgO(s) ——> MgSO4(s)
3. Oksida Amfoterik (di tengah Tabel Periodik) memiliki sifat asam dan basa sekaligus. Oksida tersebut dapat bereaksi dengan asam maupun basa.
Al2O3(s) + 6 HCl(aq) ——> 2 AlCl3(aq) + 3 H2O(l)
Al2O3(s) + 6 NaOH(aq) + 3 H2O(l) ——> 2 Na3Al(OH)6(aq)
Natrium Klorida dan Magnesium Klorida merupakan senyawa ionik dengan struktur kristalin yang teratur. Saat dilarutkan dalam air, kedua senyawa tersebut menghasilkan larutan netral (pH = 7). Sementara itu, Aluminium Klorida membentuk struktur dimernya, yaitu Al2Cl6 (untuk mencapai konfigurasi oktet). Senyawa dimer ini larut dalam air.
Al2Cl6(s) + 12 H2O(l) ——> 2 [Al(H2O)6]3+(aq) + 6 Cl–(aq)
Cairan Silikon (IV) Klorida dan gas PCl5 merupakan molekul kovalen sederhana. Masing-masing senyawa bereaksi hebat dengan air membentuk gas HCl. Reaksi ini dikenal dengan istilah hidrolisis. Larutan yang terbentuk bersifat asam. Reaksi yang terjadi adalah sebagai berikut :
SiCl4(l) + 2 H2O(l) ——> SiO2(s) + 4 HCl(g)
PCl5(s) + 4 H2O(l) ——> H3PO4(aq) + 5 HCl(g)
Dengan demikian, senyawa halida yang dibentuk dari unsur periode ketiga dapat dikelompokkan menjadi dua, yaitu :
1. Logam Klorida ( di sebelah kiri Tabel Periodik) memiliki struktur kristalin ionikdan mudah bereaksi dengan air membentuk larutan netral. Logam Klorida bersifat netral.
2. Nonlogam Klorida (di sebelah kanan Tabel Periodik) memiliki struktur molekul kovalen sederhana dan bereaksi dengan air menghasilkan larutan asam. Nonlogam Klorida bersifat asam.
Referensi:
Andy. 2009. Pre-College Chemistry.
Cotton, F. Albert dan Geoffrey Wilkinson. 1989. Kimia Anorganik Dasar. Jakarta: Penerbit UI Press
Chang, Raymond. 2007. Chemistry Ninth Edition. New York: Mc Graw Hill.
Ratcliff, Brian, dkk. 2006. AS Level and A Level Chemistry. Dubai: Oriental Press.
Moore, John T. 2003. Kimia For Dummies. Indonesia: Pakar Raya.
0.000000
0.000000

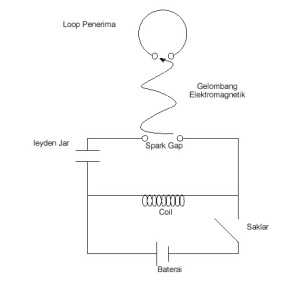










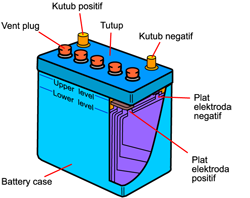























 Jumlah penduduk dunia terus meningkat setiap tahunnya, sehingga peningkatan kebutuhan energi pun tak dapat dielakkan. Dewasa ini, hampir semua kebutuhan energi manusia diperoleh dari konversi sumber energi fosil, misalnya pembangkitan listrik dan alat transportasi yang menggunakan energi fosil sebagai sumber energinya. Secara langsung atau tidak langsung hal ini mengakibatkan dampak negatif terhadap lingkungan dan kesehatan makhluk hidup karena sisa pembakaran energi fosil ini menghasilkan zat-zat pencemar yang berbahaya.Pencemaran udara terutama di kota-kota besar telah menyebabkan turunnya kualitas udara sehingga mengganggu kenyamanan lingkungan bahkan telah menyebabkan terjadinya gangguan kesehatan. Menurunnya kualitas udara tersebut terutama disebabkan oleh penggunaan bahan bakar fosil yang tidak terkendali dan tidak efisien pada sarana transportasi dan industri yang umumnya terpusat di kota-kota besar, disamping kegiatan rumah tangga dan kebakaran hutan. Hasil penelitian dibeberapa kota besar (Jakarta, Bandung, Semarang dan Surabaya) menunjukan bahwa kendaraan bermotor merupakan sumber utama pencemaran udara. Hasil penelitian di Jakarta menunjukan bahwa kendaraan bermotor memberikan kontribusi pencemaran CO sebesar 98,80%, NOx sebesar 73,40% dan HC sebesar 88,90% (Bapedal, 1992).
Jumlah penduduk dunia terus meningkat setiap tahunnya, sehingga peningkatan kebutuhan energi pun tak dapat dielakkan. Dewasa ini, hampir semua kebutuhan energi manusia diperoleh dari konversi sumber energi fosil, misalnya pembangkitan listrik dan alat transportasi yang menggunakan energi fosil sebagai sumber energinya. Secara langsung atau tidak langsung hal ini mengakibatkan dampak negatif terhadap lingkungan dan kesehatan makhluk hidup karena sisa pembakaran energi fosil ini menghasilkan zat-zat pencemar yang berbahaya.Pencemaran udara terutama di kota-kota besar telah menyebabkan turunnya kualitas udara sehingga mengganggu kenyamanan lingkungan bahkan telah menyebabkan terjadinya gangguan kesehatan. Menurunnya kualitas udara tersebut terutama disebabkan oleh penggunaan bahan bakar fosil yang tidak terkendali dan tidak efisien pada sarana transportasi dan industri yang umumnya terpusat di kota-kota besar, disamping kegiatan rumah tangga dan kebakaran hutan. Hasil penelitian dibeberapa kota besar (Jakarta, Bandung, Semarang dan Surabaya) menunjukan bahwa kendaraan bermotor merupakan sumber utama pencemaran udara. Hasil penelitian di Jakarta menunjukan bahwa kendaraan bermotor memberikan kontribusi pencemaran CO sebesar 98,80%, NOx sebesar 73,40% dan HC sebesar 88,90% (Bapedal, 1992).

 Emisi CO2 adalah pemancaran atau pelepasan gas karbon dioksida (CO2) ke udara. Emisi CO2 tersebut menyebabkan kadar gas rumah kaca di atmosfer meningkat, sehingga terjadi peningkatan efek rumah kaca dan pemanasan global. CO2 tersebut menyerap sinar matahari (radiasi inframerah) yang dipantulkan oleh bumi sehingga suhu atmosfer menjadi naik. Hal tersebut dapat mengakibatkan perubahan iklim dan kenaikan permukaan air laut.
Emisi CO2 adalah pemancaran atau pelepasan gas karbon dioksida (CO2) ke udara. Emisi CO2 tersebut menyebabkan kadar gas rumah kaca di atmosfer meningkat, sehingga terjadi peningkatan efek rumah kaca dan pemanasan global. CO2 tersebut menyerap sinar matahari (radiasi inframerah) yang dipantulkan oleh bumi sehingga suhu atmosfer menjadi naik. Hal tersebut dapat mengakibatkan perubahan iklim dan kenaikan permukaan air laut.





























PENGOMENTAR TERAKHIR